Dos de los cinco candidatos vacunales cubanos contra la COVID-19 ya están en la fase III de ensayos clínicos, una noticia que nos llena de orgullo. Esta etapa, que está desarrollada para probar la eficacia, seguridad e inmunogenicidad de los proyectos, se realiza con rigor científico en las localidades escogidas para ese fin.
Soberana 02, creada por el Instituto Finlay de Vacunas, hizo historia el tres de marzo al convertirse en el primero de América Latina en pasar la última fase de estudio. Hasta el pasado viernes 14 538 personas habían participado en el ensayo. La investigación avanza a buen ritmo, según dieron a conocer el pasado viernes en la Mesa Redonda, y la primera semana transcurrió de forma satisfactoria, con el protocolo establecido y buenas prácticas clínicas.
Está prevista en esta fase vacunar a un total de 44010 voluntarios distribuidos en ocho municipios de La Habana: Plaza, Playa, 10 de Octubre, Centro Habana, Marianao, Habana Vieja, Cerro y La Lisa, locaciones seleccionadas a partir de la incidencia del nuevo coronavirus. En el proceso participarán más de 30 sitios clínicos y 48 vacunatorios.
Hasta el momento las autoridades encargadas del estudio no han reportado eventos adversos en los pacientes. Solo fueron detectados dolor en la zona del pinchazo en algunos sujetos y malestar general en las primeras 24 horas de administrado el candidato a vacuna.
Para pasar a la fase III, este pasó por un riguroso proceso de aprobación como está estipulado en Cuba y a nivel internacional. Tanto Soberana 02 como Abdala fueron avalados para iniciar esa etapa por el Centro Estatal de Calidad de Medicamentos y Dispositivos Médicos (CECMED). La entidad justificó como un criterio de peso para su decisión que ambos candidatos obtuvieron buenos resultados de inmunogenicidad en fases previas, es decir, se detectó en los sujetos presencia de anticuerpos y de anticuerpos neutralizantes contra el virus.
ENSAYO CLÍNICO DE FASE III DE SOBERANA O2
| Criterios de inclusión | Criterios de exclusión |
|
|
Se prevé que el ensayo clínico de fase III de Soberana 02 finalice el siete de noviembre de 2021 y que los resultados estén disponibles el 15 de enero de 2022.
FASE III DE ENSAYO CLÍNICO DE ABDALA EN EL ORIENTE CUBANO
Este lunes 22 de marzo, comenzó en los municipios cabeceras de provincias Granma, Guantánamo y Santiago de Cuba la esperada fase III del candidato vacunal Abdala, desarrollado por el Centro de Ingeniería Genética y Biotecnología (CIGB).
Al respecto, la investigadora responsable de la investigación, María del Carmen Ricardo, informó a ACN que en la etapa participarán 48 mil voluntarios: seis mil bayameses, 12 mil guantanameros y 30 mil santiagueros.
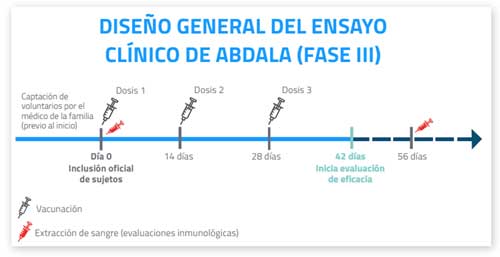
El estudio, afirmó la especialista, se llevará a cabo por alrededor de 500 profesionales de la salud capacitados en buenas prácticas.
ENSAYO CLÍNICO DE FASE III DE ABDALA
| Criterios de inclusión | Criterios de exclusión |
Individuos con edades entre 19 y 80 años Examen físico sin alteraciones significativas Voluntariedad del sujeto mediante la firma del consentimiento informado |
|
La fecha de culminación del ensayo será el 31 de julio de este año y los resultados estarán disponibles el 16 de agosto.
ENSAYO DE INTERVENCIÓN EN POBLACIONALES DE RIESGO DE INFECCIÓN, ENFERMEDAD Y DISPERSIÓN DE LA EPIDEMIA
Este 22 de marzo comenzó también otro estudio relacionado a un candidato vacunal. Se trata esta vez de un ensayo de intervención de la vacuna Soberana 02, el cual evaluará los efectos directos e indirectos del fármaco en población de riesgo de infección y dispersión de la enfermedad.
Al menos 150 000 voluntarios participarán en la primera etapa de grupos de riesgo como los trabajadores de la Salud y el sector Biofarmacéutico. Recientemente a través de Twitter el Centro de Inmunología Molecular y el Instituto Finlay de Vacunas anunciaban que sus científicos ya participaban en ese estudio.
ENSAYO DE INTERVENCIÓN PARA EVALUAR LOS EFECTOS DIRECTOS E INDIRECTOS DE LA VACUNACIÓN ANTI SARS COV 2 EN COHORTES POBLACIONALES DE RIESGO DE INFECCIÓN, ENFERMEDAD Y DISPERSIÓN DE LA EPIDEMIA (COVID-19)
| Criterios de inclusión | Criterios de exclusión |
|
|
Se estima que finalice el primero de agosto de 2022 y que los resultados estén disponibles el 31 de octubre de ese mismo año.
DISPONIBILIDAD DE VACUNAS
Sobre la disponibilidad de las vacunas para la realización de los ensayos, el Grupo Empresarial de las Industrias Biotecnológica y Farmacéutica de Cuba (BioCubaFarma), afirmó que la producción está asegurada al igual que la distribución.
“En estos momentos seis líneas de producción en varias empresas de BioCubaFarma ya están en función de fabricar estas vacunas y podrán incorporarse otras de ser necesario”, comunicó vía Twitter.
Añadió que a más tardar en el mes de agosto se habrán fabricado las dosis requeridas para inmunizar a toda la población cubana.

Por otra parte, el director del Centro de Inmunología Molecular, Eduardo Ojito, comentó a la prensa que Cuba tiene capacidad tecnológica disponible para producir millones de dosis mensuales, lo que se traduce en más de 100 mil bulbos diarios.
Información de LAYDIS MILANÉS / Cubahora

comentarios que irrespeten los criterios ajenos, ofendan, usen frases
vulgares o atenten contra la dignidad de una persona o grupo social.